中国科学院微生物研究所等团队的一项研究表明, LALA突变的CB6人员单克隆抗体在体外实验中展现出较强的中和活性,随后的非人灵长类动物试验则发现,该抗体能够有效治疗和预防新型冠状病毒(SARS-CoV-2)感染,并减少与感染相关的肺损伤。
上述研究于当地时间5月26日被顶级学术期刊《自然》(Nature)以“加快评审文章 (Accelerated Article Preview) ”形式在线发表,题为“A human neutralizing antibody targets the receptor binding site of SARS-CoV-2”。该项研究由中国科学院微生物研究所严景华团队、高福团队、王奇慧团队联合中科院武汉病毒所、北京地坛医院、解放军总医院第五医学中心、国家疾病预防控制中心病毒病研究所、上海君实生物医药科技股份有限公司等机构联合完成。
通讯作者为解放军总医院王福生院士,中科院武汉病毒所袁志明研究员,中科院微生物所王奇慧研究员、高福院士和严景华研究员。

这篇论文首次报道了在非人灵长类动物试验模型中,能够有效治疗和预防新型冠状病毒(SARS-CoV-2)感染的特异性、全人源单克隆抗体。据中国科学院微生物研究所介绍,作为由中国科学院自主研发的具有重大临床应用前景的抗体药物,该产品已申请发明专利并进入产业化快速发展通道。并预期将在近期申请临床试验。
截至5月25日,全球确诊感染新型冠状病毒的人数已超过520万,死亡人数超过33万。但目前仍无特效药物和疫苗用于治疗和预防新型冠状病毒感染,成为人类的重大威胁。
值得注意的,研究团队在论文中还特别指出,“此前,国际病毒分类委员会(ICTV)将新冠病毒命名为SARS-CoV-2,但许多病毒学家认为HCoV-19更合适”。
两株单克隆抗体被鉴定能够阻断SARS-CoV-2-RBD与hACE2受体的结合
新冠病毒是继SARS-CoV、MERS-CoV之后第三种高致病性冠状病毒,它和SARS-CoV一样使用受体血管紧张素转换酶2(ACE2)进入细胞。目前,大多数的治疗研发方案都瞄准新冠病毒入侵人类的“钥匙”——S蛋白(刺突糖蛋白)。S蛋白介导病毒和宿主细胞结合并入侵,它由S1结构域和S2结构域两部分组成,分别介导受体结合和膜融合。
近期,包括高福等学者在内的多家科研机构解析了位于S1的S蛋白受体结合域RBD及其与人类受体hACE2复合物的晶体结构。此前的研究显示,大量抗体通过靶向SARS-CoV或MERS-CoV的RBD表现出中和活性,推测可能是通过干扰病毒受体的结合。

在这项研究中,研究团队试图从康复患者中分离出抗SARS-CoV-2的单克隆中和抗体(MAbs)。论文提到,研究团队从COVID-19康复期患者外周血单核细胞(PBMCs)中筛选特异性记忆B细胞。两株单克隆抗体CA1和CB6的被鉴定能够阻断SARS-CoV-2-RBD与hACE2受体的结合。
流式细胞仪(FACS)对CA1和CB6的结合分析显示,两株单克隆抗体均能特异性结合SARS-CoV-2 S蛋白转染HEK293T细胞,而不能特异性结合SARS-CoV S或MERS-CoV S转染细胞。结合动力学测试显示,CA1和CB6与SARS-CoV-2-RBD的平衡常数(KD)的分别为4.68±1.64 nM和2.49±1.65 nM。

随后他们利用体外表达SARS-CoV-2 S抗原的假病毒,研究了CA1和CB6对SARS-CoV-2感染的中和能力。结果显示,CA1和CB6均可抑制假病毒转导至Huh7细胞、Calu-3和HEK293T细胞。
值得注意的是,就50%的中和剂量(ND50)而言,CB6比CA1具有更强的中和活性。与此一致,在SARS-CoV-2感染Vero E6细胞时,CB6也表现出强于CA1的中和活性,CB6的ND50为0.036±0.007微克/毫升,CA1为0.38微克/毫升。
总之,两种单克隆抗体均在SARS-CoV-2感染体外实验中展示出较强的中和活性,CB6则表现更为出色。
恒河猴试验:CB6-LALA可以抑制SARS-CoV-2病毒滴度,并减少感染相关的肺损伤
研究团队进一步在在恒河猴SARS-CoV-2感染模型中进行CB6单抗测试。
值得一提的是,考虑到在SARS-CoV感染中观察到的抗体依赖性增强(ADE)副作用的潜在风险,研究团队将CB6的Fc部分进行了LALA突变(CB6-LALA),以降低Fc介导的急性肺损伤的风险。
治疗组3只恒河猴(6-8岁)经气管内攻毒1×105 50%组织培养感染剂量(TCID50)SARS-CoV-2。CB6-LALA (50 mg/kg)于感染后(dpi)第1天和第3天腹腔注射。对照组(n=3)在1dpi和3dpi均给予等量的磷酸盐缓冲盐水(PBS)。每日检测咽拭子病毒滴度,直至7dpi。

在对照组中,病毒载量在4dpi时达到峰值水平(约106.5 RNA拷贝/毫升),然后自然下降。相比之下,CB6-LALA治疗组可在给药后立即降低病毒滴度。
此外,除治疗组之外,研究团队还设置了预防组试验。3只恒河猴的结果显示,在SARS-CoV-2攻毒前给予单剂量CB6-LALA(50 mg/kg)可显著保护它们不受SARS-CoV-2感染。这组咽拭子仅检测到最低水平的病毒,病毒载量峰值不超过103个RNA拷贝/mL,提示CB6-LALA抗体对SARS-CoV-2感染具有较强的预防保护作用。
除了降低病毒滴度外,研究团队还进一步研究了CB6-LALA是否也能抑制SARS-CoV-2感染猴子的病理性肺损伤。每组均有一只猴子在5dpi时被实施安乐死。

结果发现,对照组动物表现为间质性肺炎,以肺泡间隔增厚、成纤维细胞增殖和纤维化为特征,单核细胞和淋巴细胞大量浸润。在一些肺泡腔中,可以观察到纤维素渗出,形成透明膜和肺出血。肺毛细血管腔内也有明显血栓形成,细支气管内有坏死和脱落的上皮细胞积聚。
相比之下,预防性治疗或感染后治疗的猴子表现出有限的病理性肺损伤。和对照组相比,预防组合治疗组猴子都保持整体完整的肺泡结构、水肿减少、没有形成透明膜、纤维化显著减少和白细胞渗入减少。此外,研究团队没有观察到严重的小支气管和肺毛细血管病变。
因此,研究认为,无论是预防还是治疗,CB6-LALA都可以抑制SARS-CoV-2病毒滴度,并减少感染相关的肺损伤。
CB6的阻断中和机制
研究团队还制备了CB6-Fab/SARS-CoV-2-RBD的蛋白复合物的晶体,获得分辨率为2.9 Å(埃)的复合物三维结构,进一步从结构层面研究了CB6的阻断中和机制。为了分析CB6对SARS-CoV-2-RBD/hACE2相互作用的阻断机制,研究团队还将CB6-Fab /SARS-CoV-2-RBD复合物结构与hACE2/SARS-CoV-2-RBD复合物叠加。
结果显示,CB6的结合引起了hACE2结合的空间位阻,这是由CB6的VH和VL介导的(图4e)。在RBD上,CB6和hACE2之间也存在大量重叠的结合区域。
综上所述,研究认为CB6的阻断机制既依赖于其VH,也依赖于VL,通过空间位阻和直接的界面残基竞争来阻断hACE2与SARS-CoV-2-RBD的结合。
值得注意的是,CB6的SARS-CoV- 2-RBD上的相互作用的表位与hACE2的结合表位高度重叠,表明它对SARS-CoV-2突变变体会具有很强的耐药性。

研究团队提到,“据我们所知,这是利用非人类灵长类动物评估单克隆抗体对SARS-CoV-2中和作用的首份报告,将有助于临床试验中给药方案的设计。”这项研究的数据表明,从COVID-19康复期患者中分离出的具有中和作用的单克隆抗体CB6可能是一种潜在的COVID-19治疗药物,值得进一步的转化研究。
值得注意的是,就在十几天之前,当地时间5月13日,顶级学术期刊《科学》(Science)在线发表了来自由高福等人领衔完成的另一项研究,他们从一名新冠康复患者中分离出的两种单克隆抗体B38和H4抗体,可以阻止病毒S蛋白受体结合区域RBD与人体细胞受体ACE2之间的结合。随后在小鼠模型中的治疗研究证实,这两种抗体可降低小鼠感染后肺部的病毒载量。

中科院微生物研究所表示,本次研发的中和抗体具有临床应用的重大前景。目前已经完成技术转化和治疗性抗体的生产工艺建设,产业化进展顺利,预期将在近期申请临床试验。“一旦成功上市,将会为世界疫情防控工作做出来自中国科学院的贡献。”
论文链接:https://www.nature.com/articles/s41586-020-2381-y_reference.pdf
相关报道:首个新冠病毒中和抗体恒河猴实验结果发布:有治疗和预防潜力
作者 |第一财经 林志吟
5月26日傍晚,中国科学院微生物研究所和君实生物(01877.HK)等在《自然》杂志上在线发表了其合作研发的新冠病毒中和抗体在恒河猴的治疗和预防实验结果,这也是首个在非人灵长类动物模型中的抗新冠病毒中和抗体实验报告。该报告初步表明,改造后的中和抗体CB6-LALA能够抑制SARS-CoV-2的感染,观察到治疗和预防的效果。
据报告显示,研究首先从恢复期患者外周血单个核细胞中(PBMC)分离出SARS-CoV-2 中和性单克隆抗体(mAb ),通过单细胞测序技术筛选出两个均能阻断SARS-CoV-2-RBD与在HEK293T 细胞上瞬时表达的hACE2受体结合的单克隆抗体, CA1和CB6。与CA1相比,CB6表现出更强的中和活性。在开始实验前,基于前期的发现,为了防止潜在的抗体依赖性增强(ADE)效应,研究者在CB6的Fc段引入了LALA突变(CB6-LALA)以消除抗体依赖性细胞介导的细胞毒性作用(ADCC),降低Fc介导的肺损伤的风险。
该报告显示,在恒河猴动物模型实验上,证实了中和抗体CB6-LALA的治疗作用和预防潜力。

据显示,在治疗组中(n = 3),受到SARS-CoV-2 感染的动物在感染后第1和第3天给予静脉注射CB6-LALA(50 mg / kg)治疗。对照组(n = 3)的动物在感染后第1天和第3 天给予等体积的磷酸盐缓冲液(PBS)静脉注射。每天评估咽拭子的病毒滴度,直至感染后7天。
研究结果显示,在对照组中,病毒载量在感染后第4天达到峰值水平(约106.5RNA拷贝/ mL),然后自然下降。治疗组的动物在感染后的第4天,CB6-LALA给药后病毒效价显著降低,治疗组病毒滴度比对照组降低了约3个对数。
与此同时,预防组(n = 3)的动物在感染SARS-CoV-2前静脉注射单剂CB6-LALA (50 mg / kg),在观察期间的咽拭子评估中,仅检测到最低水平的病毒滴度,病毒滴度峰值不超过103RNA 拷贝/ mL,表明CB6-LALA在SARS-CoV-2环境下具有很强的预防保护作用。
基于目前的数据分析,研究者们认为,CB6是新型冠状病毒肺炎的潜在治疗可能,值得进一步转化发展。该动物实验结果,也将有助于指导临床试验的方向和设计。
中和抗体是一种可通过中和或抑制病原体(例如病毒)的生物学活性来保护细胞免受侵害的治疗性抗体。抗体可以通过工程化实现药物量产,从而保证临床大量应用。这由此也吸引了全球多个研究团队正在介入研发相关的抗击新冠病毒的中和抗体中。
按照君实生物前期发布的计划,公司和礼来制药计划在第二季度在美国递交IND申请并启动临床研究。
延伸阅读:新冠病毒研究最新发现(重磅)| Science揭示SARS-CoV-2感染可以保护恒河猴不被再次感染
当下,新冠肺炎疫情全球蔓延。然而,我们对SARS-CoV-2免疫机制的了解非常有限。目前还不清楚SARS-CoV-2感染是否会导致人体产生自然免疫,从而保护再次暴露的人群。这是一个至关重要的问题,对疫苗开发、公共卫生战略、以抗体为基础的治疗方法以及群体免疫的体外微生物学模型具有深远的影响。
为了探索这个问题, 2020年5月20日,来自哈佛医学院病毒和疫苗研究中心DanH. Barouch团队在Science杂志上发表了题为 “SARS-CoV-2 infection protects against rechallenge in rhesus macaques”的研究论文。他们 开发了SARS-CoV-2感染的恒河猴模型,评估了感染的病毒学、免疫学和病理学特征以及对再次感染的保护性免疫,发现SARS-CoV-2感染可以避免恒河猴再次感染。
我们一起来看看这项最新发现吧!
1. 构建SARS-CoV-2感染的恒河猴模型
将9只6-12个月大的恒河猴,分为三组,每组三只,各组分别以鼻(1ml)和气管(1ml)的方式接种了1.1 × 106 PFU, 1.1 × 105 PFU, 1.1 × 104 PFU的 SARS-CoV-2。
通过RT-PCR在多个解剖部位检测了病毒RNA水平,从支气管肺泡灌洗液(bronchoalveolar lavage,BAL)和 鼻拭子(nasalswabs,NS)中观察到了高水平的病毒RNA。第1至2天,所有动物的鼻拭子中的病毒RNA都增加了,这表明病毒进行了复制。病毒RNA在第2天达到高峰,一般支气管肺泡灌洗液在第10-14天,鼻拭子在第21-28天消失。
2. 恒河猴SARS-CoV-2感染的病毒学和免疫学研究
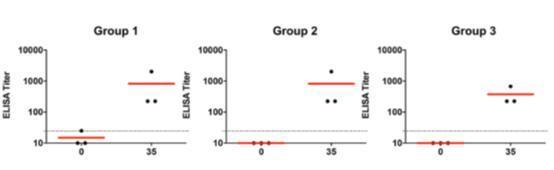
9只恒河猴经ELISA检测发现均对SARS-CoV-2 Spike (S)蛋白产生了结合抗体反应。使用伪病毒中和试验和活病毒中和试验均产生了中和抗体反应。所有动物在第35天,无论剂量组,鼻拭子滴度约为100。观察到多个亚类抗体对受体结合域(RBD)、融合前外域(S)和核衣壳(N)的应答抗体表现出多种效应。
通过IFN-γ ELISPOT方法,在多数动物中观察到细胞对合并的S肽的免疫反应,低剂量组呈现更低的免疫反应。细胞内细胞因子染色显示,诱导了特异性CD8+和CD4+ T细胞反应。
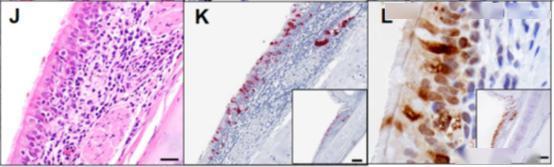
3. SARS CoV-2感染引起恒河猴急性病毒性间质性肺炎
目前只能获得有限的SARS-CoV-2感染人类的病理数据,为了评估SARS-CoV-2在恒河猴中的感染特点,研究者通过上述方法接种了4只恒河猴,每只病毒滴度为1.1×105PFU。接种后第2天(N= 2)和第4天(N = 2)对动物进行了分析解剖分析和病理学检测。通过分析表明,SARS-CoV-2可导致急性炎症和病毒性肺炎的多灶区,包括受感染的肺细胞、纤毛气道上皮细胞和其他可能的细胞类型。
4. SARS-CoV-2对恒河猴再感染的保护作用
上述9只恒河猴在病毒感染后的第35天,使用与初次感染相同剂量的SARS-CoV-2对其进行了再次接种,同时使用3只新动物作为再感染实验的阳性对照。与原发感染相比, 支气管肺泡灌洗液和鼻黏膜中值病毒载量降低了5.1 log10。同时发现在SARS-CoV-2再感染后,动物表现出快速的记忆免疫反应,所有动物在再激发后都产生了抗体应答。

5. 总结
恒河猴SARS-CoV-2感染可诱导体液和细胞免疫应答,并且对SARS-CoV-2再次暴露具有保护效果。这些数据增加了用免疫学方法预防和治疗SARS-CoV-2感染的可能性。
6. 存在问题及研究方向
恒河猴和人类在两个物种上SARS-CoV-2感染之间存在着重要的差异。因此应谨慎解释该研究的数据。需要进行严格的临床研究,以确定人类SARS-CoV-2感染是否能有效防止再次暴露感染,起到防护作用。
通过SARS-CoV-2感染的恒河猴模型,该模型概括了人类SARS-CoV-2感染的许多方面,包括上、下呼吸道的高水平病毒复制和病毒性肺炎的病理证据。这些数据表明,猕猴可以作为SARS-CoV-2感染的模型,用于测试免疫因子和治疗方法以及研究免疫发病机制,该研究结果补充和扩展了B. L. Haagmans等最近在Science上发表的食蟹猕猴的数据[1]。然而,这两种非人类灵长类动物模型都没有导致呼吸衰竭或死亡,因此需要进一步的研究来建立一种非人类灵长类动物的严重COVID-19疾病模型。
由于SARS-CoV-2再感染对所有动物几乎具有完全保护作用,无法确定本研究中的保护的免疫相关性。恒河猴SARS-CoV-2感染诱导中和抗体,但中和抗体的相对重要性,其他功能性抗体,细胞免疫,先天免疫保护效果与SARS-CoV-2仍有待确定。此外,还需要进一步的研究来确定自然免疫的持久性。


