6月27日,Intellia Therapeutics公司和再生元(Regeneron)公司联合宣布,在研CRISPR体内基因组编辑疗法NTLA-2001在1期临床试验中获得积极结果:单剂NTLA-2001导致血清中的转甲状腺素蛋白水平(TTR)平均下降87%,在第28天TTR降低幅度最大可达96%。
对此,博雅辑因首席执行官魏东接受《每日经济新闻》记者采访时表示,Intellia Therapeutics此次临床试验数据的发布意味着首次体内基因编辑疗法临床试验的成功,该临床试验数据展现了体内使用CRISPR/Cas系统的基因编辑疗法的高基因编辑效率、安全性以及潜在的一次性治愈可能性,在行业内看来这是非常优秀的成绩。
全球首个人体体内
基因编辑临床试验结果公布
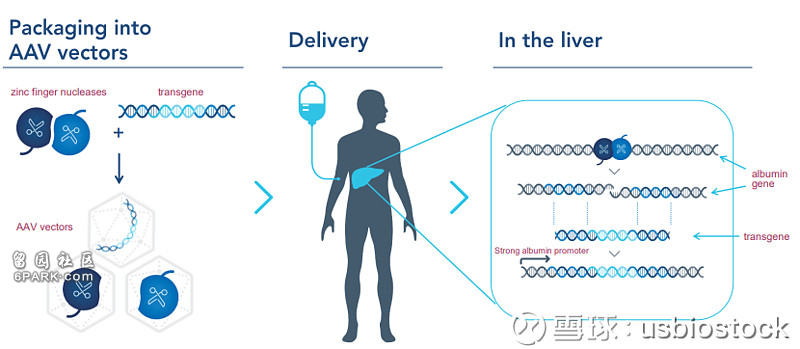
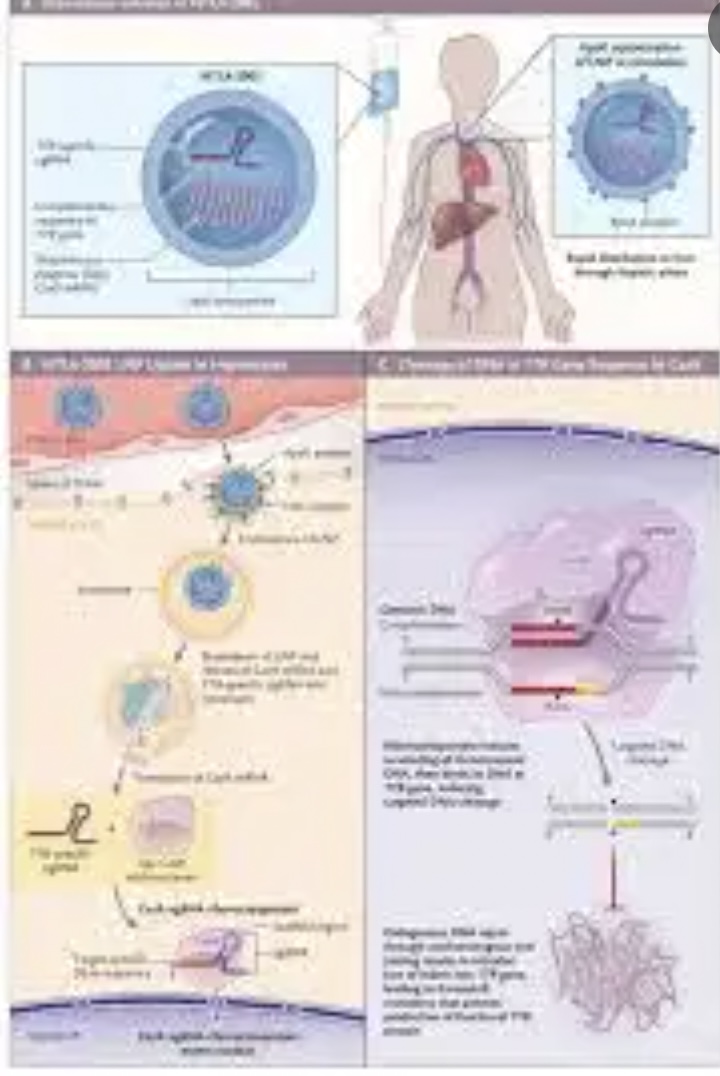
据了解,NTLA-2001是一款在体内进行基因编辑的创新疗法,它通过脂质纳米颗粒(LNP),包装靶向TTR基因的CRISPR基因编辑系统。
研究结果显示,本次临床试验数据包括了在1期临床试验中接受治疗的6名ATTR患者,其中3名接受剂量为0.1 mg/kg的NTLA-2001的治疗,另外3名接受剂量为0.3 mg/kg的NTLA-2001的治疗。
在接受治疗第28天的检测显示,NTLA-2001能够剂量依赖性降低患者血清中的TTR水平。0.1 mg/kg剂量组TTR平均下降52%,0.3 mg/kg剂量组TTR平均下降87%,其中一名患者TTR水平下降96%。
“这是一个激动人心的数据,体现了该疗法的有效性。”魏东在采访中指出,这主要是考虑到Intellia目前使用的仍是相对较低的剂量,已经实现了这样的疗效。Intellia也表示之后会尝试更高的剂量,使得该数据达到90%以上。如果长期观察该水平可以持续,这也表明了体内基因编辑疗法也有可能实现一次性治愈。
研究结果还显示,在安全性方面,截至接受治疗后第28天,NTLA-2001表现出良好的安全性,没有发现严重不良事件和肝脏问题。所有不良事件均为轻度不良事件(1级)。
“虽然目前观察的时间相对较短,但是此前行业内比较担心的脱靶效应和安全性问题两个潜在风险都没有出现。”魏东解释称,一个潜在风险是,因为Cas 9本身是蛋白,是否会引起免疫反应,此次试验没有观察到相关问题。另外一个是关于基因编辑是否会产生脱靶效应而导致显著副作用。
他强调,此次临床试验并没有观察到明显的脱靶效应或者任何和基因编辑相关的具临床意义的副作用。
突破:基因编辑技术经过严谨开发
可以被转化为安全疗法
《每日经济新闻》记者注意到,上述研究结果同时在《新英格兰医学杂志》上发表,全球医学界为之振奋。
Intellia总裁兼首席执行官John Leonard博士表示,这是有史以来首次临床数据表明可能通过单次静脉输注CRISPR系统,在患者体内精准编辑靶细胞从而治疗遗传疾病,中期结果显示NTLA-2001具有在单次给药的情况下中止和逆转ATTR的潜力。解决将CRISPR/Cas9系统靶向递送至肝脏的挑战,也为使用我们的技术平台治疗广泛的其他遗传疾病打开了大门。
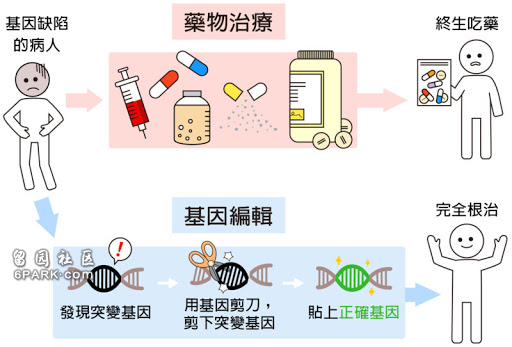
“从专业的角度来看,这是基因编辑行业内一直以来期待的数据,使整个领域看到了很大的希望。”魏东则告诉记者,此前通过CRISPR Therapeutics等针对输血依赖型地中海贫血和镰刀型贫血病的临床试验,已经证明了基因编辑技术可以在体外基因编辑中带来一次性治愈可能,这些数据显示了基因编辑技术在一次性治愈疾病方面的巨大潜力,“这是颠覆现有治疗方法和标准的”。
他举例称,比如针对此次Intellia研究的疾病,目前有获批的RNAi疗法,但需要患者每三周进行一次治疗,同时有很多潜在的副作用,而如果基因编辑疗法最终被证明是一次性治愈的话,对于现有治疗方案就是一次颠覆。
与此同时,前两周在美国NASDAQ上市的Verve Therapeutics计划通过碱基编辑PCSK9基因以降低胆固醇水平。魏东指出,如果他们的疗法最终也被证明可以实现一次性治愈,那么对于相关领域的治疗也将是一次颠覆。
“当然,这是一个很好的起点,毕竟基因编辑疗法目前仍处于初级阶段,还有更多工作要做,以实现更多突破。”魏东强调,首先,无论是体内还是体外的基因编辑疗法,目前科学家更多做的还是干扰或破坏一个基因,而真正替换或者修正基因还需要应用在目前看来更复杂的技术。“我们也期望在这方面,未来能够看到更多变化”。
他也同时提到,第二点,肝脏是一个相对容易通过LNP(脂质体)或者AAV递送实现编辑的器官。而对于例如大脑或心脏等更为复杂的器官,如何编辑才能够实现治疗的同时避免安全性问题,还有很多工作要做。
第三点,就是长期的安全性和有效性。目前,无论是体外还是体内基因编辑疗法方面取得的临床方面都是最近取得的成功。一次性治愈的效果需要足够时间的观察才能验证,而如果有一些其他的脱靶效应或者潜在引起癌症方面的问题,也需要长时间的观察。这也表明了基因编辑系统在取得当前成绩的基础上,还需要长期的观察,才能够真正建立起长期的安全性数据。
中国基因编辑技术基础研究
不逊于发达国家
近年来,通过基因编辑技术治疗疾病的设想得到广泛关注。尤其2020年以来,CRISPR基因编辑技术大放光彩,获得了诺贝尔化学奖,在临床方面也取得了长足进步。然而,对于这一未知的前沿技术领域,全球尚无真正的疗法诞生,从技术到临床转化过程中还充满着各种各样的挑战。
而在中国,敢于挑战这一前沿领域的药物开发企业并不多,博雅辑因就是其中之一。魏东曾公开谈到,迈入基因编辑疗法这个充满创新和未知的科学领域,就像一下子跳进了深海。但这次,我们不想等着被浪潮推动,而是要真正走在浪潮前面。
“中国在基因编辑技术的基础研究水平上不逊色于发达国家,在相关论文和专利数上位居全球第二。”魏东提到,在转化方面,中国得益于临床研究双轨制,即研究者发起的临床试验和经药监局审批的注册性临床试验并行,基因编辑技术带来的先进疗法能够通过研究机构发起的医疗技术临床试验、积累数据,并为部分患者提供帮助。
但是,在临床转化上,中国与发达国家水平还有些距离。魏东提到,真正将基因编辑技术高质量转化为疗法并最终推向市场惠及广大患者,需要获得监管机构的临床试验申请批准并开展注册性临床试验。在美欧已有多项正式I期、II期基因编辑产品的临床试验的情况下,我国的临床转化一直处于更早期的、研究者发起的临床试验阶段。
公开资料显示,2018年,生物医药企业CRISPR Therapeutics和制药企业福泰制药(Vertex Pharmaceuticals)获得了美国和欧洲监管机构的新药研究申请批件,这也是全球首个由制药公司发起的体外CRISPR疗法的新药临床试验;同年,美国食品药品监督管理局(FDA)受理了世界首个体内CRISPR疗法的新药研究申请(IND)。
而在我国,直至2021年1月,博雅辑因针对输血依赖型β地中海贫血的基因编辑疗法产品ET-01的临床试验申请(IND)获国家药监局批准,才打破了中国基因编辑转化无临床试验申请(IND)获批的局面。今年6月,ET-01的I期多中心临床试验信息在药物临床试验登记与信息公示平台(chinadrugtrials.org.cn)上公示,表明了这一试验正在启动。


